Évaporation rotative
Principe de l’évaporateur rotatif et procédé de distillation
Le procédé de distillation permet de séparer les solvants volatils des mélanges liquides grâce à la vaporisation, puis à la condensation. En laboratoire, les chimistes et les biochimistes ont fréquemment recours au procédé de distillation et à l’évaporateur rotatif.
Historique de la distillation
D’un point de vue historique, la technique de l’évaporation rotative, ou « séparation goutte à goutte », est apparue il y a des milliers d’années. Le tableau ci-dessous retrace ainsi en détail l’évolution du procédé de distillation au fil du temps.
| 3500 avant J.-C. | Les Perses inventent la distillation dans le but de produire de l’eau de rose. La technique de la distillation connaît un essor rapide en Europe, en Afrique du Nord et en Asie. Le procédé de distillation sert à produire des essences, à dessaler l’eau de mer et pour l’alchimie. |
| IIe siècle | Au fur et à mesure que la popularité de l’alchimie, un mélange d’aspects religieux et de chimie, grandit, la recherche de la « prima materia », une matière fondamentale sans qualités, s’intensifie. Les alchimistes cherchent à transformer chimiquement des matériaux naturels en cette matière de départ, puis à conférer à cette dernière de nouvelles qualités souhaitées, comme celles de l’or. Au cours de leurs essais, ils découvrent de nombreux composés chimiques, améliorent les procédés et appareils existants et découvrent de nouvelles méthodes qui sont encore utilisées aujourd’hui dans la chimie moderne. Ils développent également une méthode de distillation qui, du point de vue de la conception, est toujours utilisée aujourd’hui. Ce matériel de distillation se compose de quatre éléments standard, à savoir le bain de chauffage, le ballon à distiller, la tête et le condenseur |
| XVIIe et XVIIIe siècles | La priorité est donnée à l’amélioration de la méthode de distillation existante. Le matériel de distillation est isolé, l’appareil est de plus en plus souvent fabriqué en verre plutôt qu’en métal, le procédé de distillation continue est introduit et l’eau est utilisée comme réfrigérant. C’estégalement à cette époque que le procédé de distillation à la vapeur est découvert. À la fin du XVIIe siècle, le physicien irlandais Robert Boyle (1627-1691) réalise les premières distillations sous vide. |
| XIXe siècle | Invention des premières colonnes de rectification afin de permettre la distillation en plusieurs étapes. Avec l’arrivée de la chimie organique, de nouveaux appareils de distillation sont spécialement conçus pour les besoins des laboratoires. La participation financière de l’industrie de l’alcool en France entraîne un développement rapide, également à une grande échelle industrielle. L’invention du régulateur de pression et l’amélioration des pompes permettent également une utilisation plus ciblée du vide. |
| 1950 à 1955 | Des articles de C.C. Draig (1950) et de M.E. Volk (1955) décrivent le principe de fonctionnement de l’évaporateur rotatif. Ce procédé a un bien meilleur taux de transfert de chaleur que le procédé à ballon, ce qui permet de préserver le produit et d’augmenter le rendement. |
| 1957 | La société BÜCHI Labortechnik sise à Flawil commercialise le premier évaporateur rotatif. |
Le procédé de distillation et la méthode d’évaporation rotative associée
L’évaporateur rotatif a été créé pour répondre aux besoins des chimistes et biochimistes du monde entier. En raison de la large gamme de condenseurs, le Rotavapor® est utilisé pour la distillation rapide de solvants mixtes, le séchage optimal des échantillons, la préparation accélérée des échantillons par lyophilisation, la synthèse chimique avec chauffage à reflux, l’extraction de composés naturels et la concentration. Les applications industrielles de l’évaporateur rotatif sont innombrables, mais elles comprennent entre autres le traitement du pétrole brut, la séparation des cannabinoïdes, la cuisson moléculaire, la création d’arômes et de parfums et bien d’autres encore.
L’évaporation dans le procédé de distillation
L’évaporation est le passage d’une particule de la phase liquide à la phase gazeuse. Le procédé d’évaporation commence dès que les conditions de pression et de température atteignent la courbe d’ébullition. À ce moment-là, toutes les particules disposent d’une énergie cinétique suffisante pour contrebalancer les forces d’attraction mutuelle qui les lient. Il ne s’agit plus seulement de quelques molécules à la surface, qui se détachent du liquide. Désormais, le passage de la phase liquide à la phase gazeuse se fait dans l’ensemble du liquide. Le point d’ébullition est indispensable à la distillation, car le liquide à séparer se vaporise beaucoup plus rapidement que lors de l’évaporation. Comme le volume molaire d’un gaz est plusieurs fois supérieur à celui d’un liquide, la matière se dilate de 1000 à 2000 fois pendant l’ébullition. Il faut veiller à ce que le matériel de distillation puisse accepter ce volume.
Ébullition nucléée pendant le procédé d’évaporation
Au cours du procédé de distillation, la première étape d’ébullition est celle de l’ébullition nucléée. La chaleur provoque l’expansion des bulles de gaz enfermées dans les parois du récipient. Les particules vaporisées quittent le liquide et passent dans ces bulles, ce qui fait grossir ces dernières. Lorsque les bulles atteignent un point où leur flottabilité peut contrebalancer les forces d’adhésion, elles se détachent partiellement de la paroi du récipient et remontent à la surface. La partie restante de la bulle sert à la formation d’une nouvelle bulle au même endroit. Un flux de dérive se forme derrière la bulle, améliorant le mélange dans le liquide. Au fur et à mesure que le liquide se réchauffe, de plus en plus de bulles se forment jusqu’à ce que, finalement, un voile de vapeur ininterrompu recouvre la paroi du récipient. Cette étape correspond à la caléfaction.
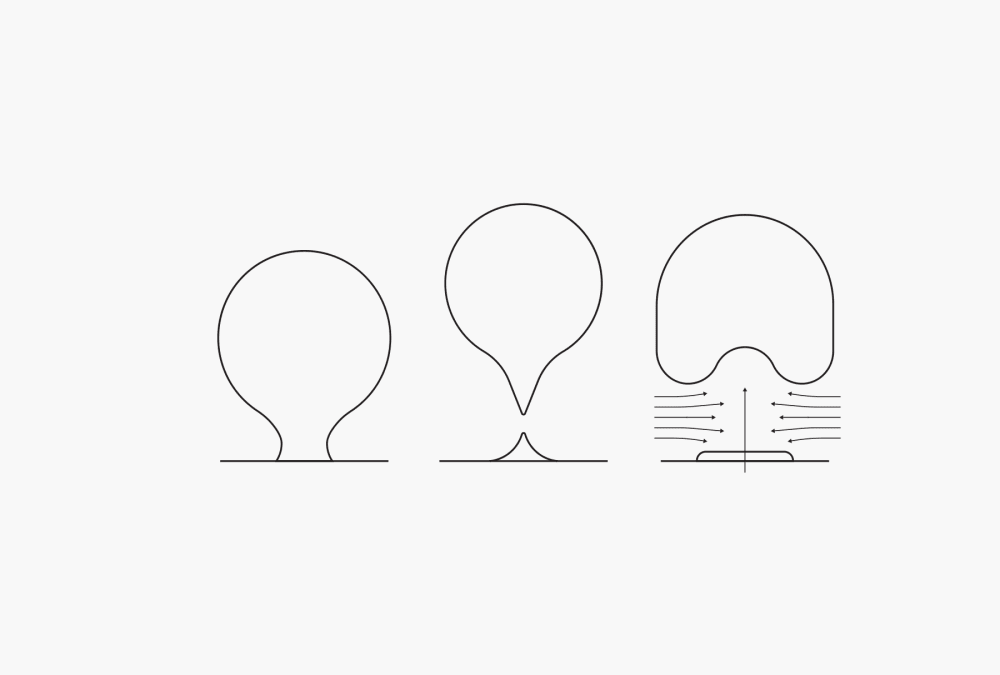
Figure 1. Ébullition nucléée
Transfert de chaleur pendant le procédé d’évaporation
L’un des aspects importants de l’ébullition est le transfert de la chaleur de la source de chaleur au liquide. Comme le liquide n’entre généralement en contact avec la source de chaleur qu’au niveau de la paroi du récipient, ses couches extérieures se réchauffent en premier. Les couches supérieures restent plus froides. Les couches chaudes remontent sous l’effet de la convection et les couches froides prennent leur place. Il en résulte une égalisation des températures, mais qui évolue très lentement. Le mélange supplémentaire au début de l’ébullition nucléée améliore effectivement le transfert de chaleur, mais la situation reste néanmoins peu intéressante. Le transfert de chaleur peut être considérablement amélioré en maintenant le liquide en mouvement à l’aide d’un mixer ou dans un ballon rotatif grâce à la méthode de l’évaporation rotative. Ce mélange continu ou cette convection forcée permet un excellent transfert de chaleur, une meilleure éjection de la forme gazeuse, et donc un procédé de distillation plus rapide.

Figure 2. Convection naturelle
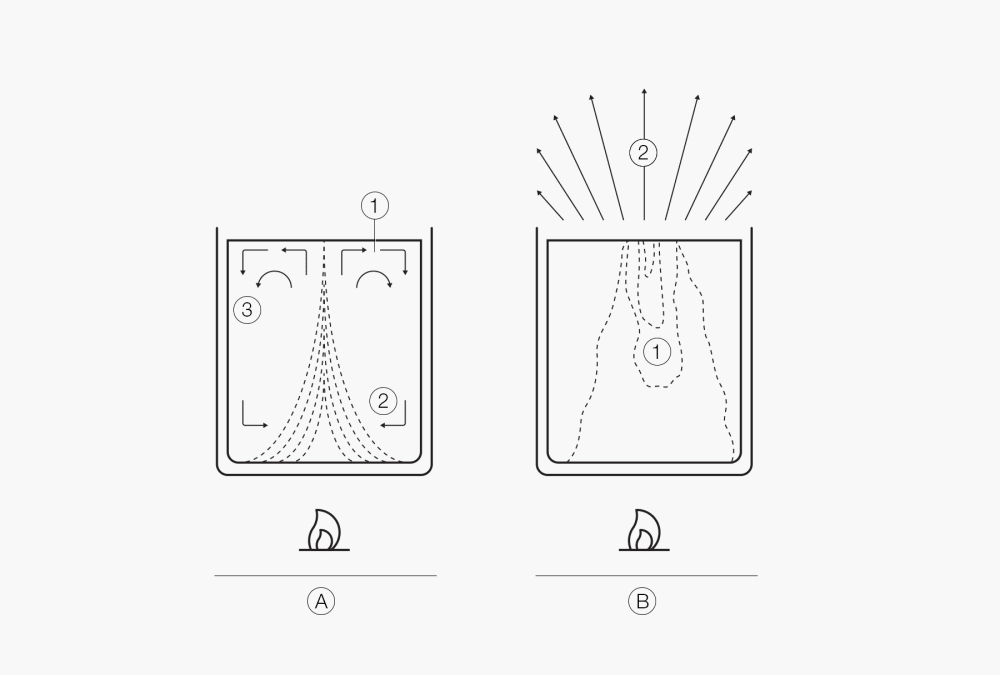
Figure 3.
Début du retard à l’ébullition (1. Bouillonnement brusque), (2. Profil de température, 3. Convection)
Retard à l’ébullition (1. Bouillonnement brusque) à la surface.
Condensation dans le procédé de distillation
La condensation désigne le renversement de ce procédé d’ébullition dans lequel une substance passe de son état gazeux à son état liquide. Comme la chaleur d’évaporation transférée aux particules pendant l’ébullition doit maintenant être retirée des particules, il est nécessaire de procéder à un refroidissement pour condenser un gaz.
La vapeur qui quitte le point de vaporisation atteint la phase de condensation. Comme la température du condenseur est inférieure à la température de condensation de la vapeur, la vapeur est précipitée et un film de liquide se forme immédiatement lorsque ses molécules atteignent le condenseur. Comme ce film fait obstacle au transfert de chaleur, il convient de prendre des mesures pour qu’il puisse s’écouler. Les condenseurs présentent donc toujours une forme verticale ou oblique. Le condensat qui s’écoule s’accumule dans un ballon collecteur. Comme le volume du gaz condensé est nettement supérieur à celui du liquide produit, la chaleur ne peut pas s’évacuer facilement. C’est pourquoi les refroidisseurs présentent généralement une très grande surface.
Pour garantir une condensation efficace tout au long du procédé de distillation, le refroidissement se fait à l’aide d’un agent réfrigérant qui peut être refroidi en permanence, par exemple de l’eau du robinet ou un refroidisseur à circulation. L’ébullition entraîne une forte augmentation de la pression. En cas de condensation, une très grande partie de la pression est dissipée. Le condenseur agit comme une pompe.
Transport du gaz dans l’évaporateur rotatif
Une distillation consiste en une vaporisation, puis en une condensation. Comme les points de vaporisation et de condensation sont généralement très éloignés l’un de l’autre, il est nécessaire de transporter la vapeur. Ce qui peut se faire aisément. Étant donné qu’un gaz se répartit uniformément dans l’espace disponible, il passe du côté évaporateur au côté condenseur, où il se liquéfie. Ce qui entraîne une baisse de volume équivalente. Il en résulte un vide local. Le côté condenseur aspire donc toujours du gaz, tandis que le côté évaporateur fournit toujours la même quantité de gaz. La différence de pression dynamique créée permet à la vapeur de se déplacer à grande vitesse dans l’appareil. Le flux est maintenu grâce à la chaleur d’évaporation transmise au gaz lors de la vaporisation. Lors de la condensation, cette chaleur est à nouveau extraite du gaz. Ce phénomène est également appelé « pompe thermique » (P).
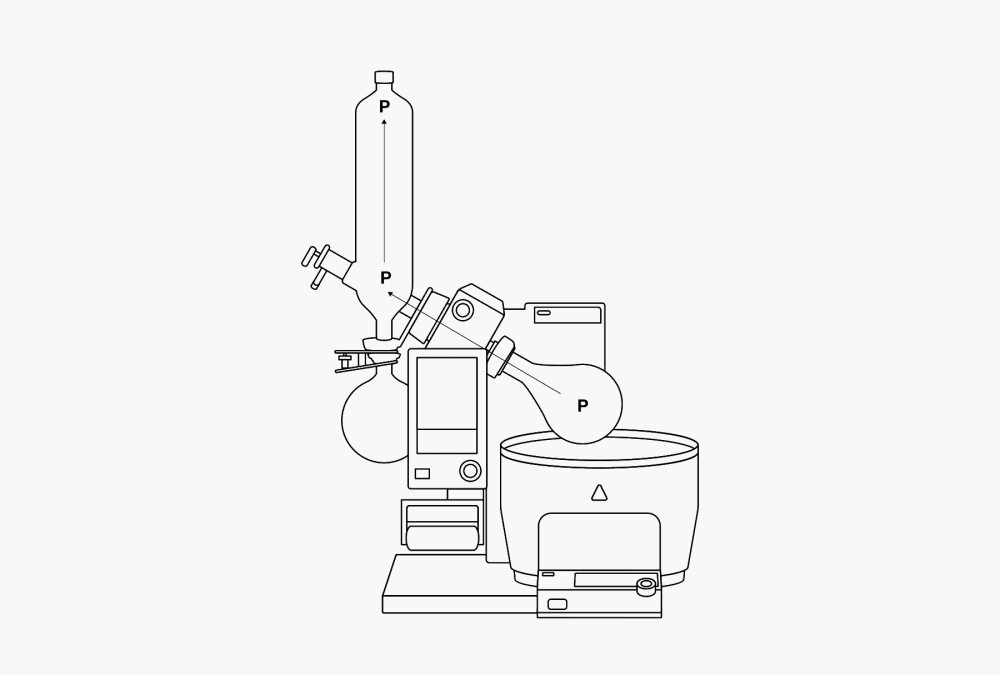
Figure 4. Pompe thermique (P) et différences locales de température dans l’évaporateur rotatif.
Il est important que la vitesse de condensation et la vitesse d’évaporation concordent afin de maintenir une différence de pression dynamique équilibrée. Chaque fois qu’une quantité de substance supérieure à celle qui est condensée dans le condenseur est vaporisée, la pression à l’intérieur de l’appareil augmente et la pompe à vide doit continuellement aspirer le solvant vaporisé et le rejeter par pompage dans le milieu environnant. Il est préférable de travailler avec une température d’ébullition d’environ 20 °C supérieure à la température de l’eau de refroidissement. De cette manière, l’équilibre thermique est préservé.
Séparation par procédé de distillation
La distillation est une technique de séparation qui permet de séparer des mélanges composés de deux liquides. Le procédé de distillation repose sur la différence entre les pressions de vapeur des substances. Le mélange est chauffé jusqu’à ce qu’il se vaporise, puis il est recondensé. Lors de ce procédé, le composant le plus volatil s’accumule dans la vapeur, et donc dans le condensat également, ce qui entraîne une séparation. La vapeur enrichie, acheminée à travers le matériel de distillation, atteint le condenseur où elle se liquéfie et est recueillie dans un flacon collecteur sous forme de distillat. Dans le même temps, le composant le moins volatil s’accumule dans le ballon d’évaporation.
Si les points d’ébullition de deux matières diffèrent de plus de 80 °C, la séparation des mélanges peut être obtenue par le biais d’une distillation unique. La distillation unique est principalement utilisée pour séparer les solvants très volatils des matières à point d’ébullition élevé. Dans ce cas, peu importe que ce soit le solvant (nettoyage des solvants) ou le résidu (nettoyage d’un produit de réaction par élimination des solvants) qui doit être récupéré. Chaque fois que les points d’ébullition des deux composants séparés sont trop proches, le procédé de distillation doit être répété plusieurs fois. Cette procédure est appelée la rectification. Par ailleurs, il est également possible d’utiliser la distillation fractionnée pour séparer deux liquides avec une légère différence de température d’ébullition. En cas de distillation fractionnée, une colonne de fractionnement, remplie de billes de verre ou de plastique, est placée entre le ballon d’ébullition et le condenseur. Les perles de verre de la colonne de fractionnement offrent une plus grande surface sur laquelle le liquide peut se condenser, s’évaporer à nouveau et se condenser à nouveau.
Le rôle du vide dans le procédé de distillation
Le vide joue un rôle important pour tous les types d’évaporateurs, car il abaisse la température d’ébullition nécessaire à la distillation. Le vide peut être contrôlé manuellement ou automatiquement en cas d’installation d’un régulateur de vide. Le vide est créé à partir d’une source de vide située à l’extérieur de l’évaporateur rotatif. Il peut s’agir soit d’une pompe de laboratoire, souvent une pompe à jet d’eau ou une pompe à diaphragme, soit d’une tubulure à vide interne. Il est possible de réguler le fonctionnement d’une pompe de laboratoire à l’aide d’un régulateur de vide, ce qui permet d’économiser de l’eau et de l’électricité et d’augmenter la durée de vie de la pompe.
Le Rotavapor® est mis sous vide et réaéré par le biais du raccord à vide situé sur l’assemblage en verre. L’emplacement de ce raccord sur l’appareil a toute son importance. Il doit se situer à l’endroit où la surpression locale accumulée par le procédé de vaporisation est à nouveau dissipée par la condensation. Il se situe tout en haut d’un refroidisseur montant et tout en bas d’un refroidisseur descendant.
