La chromatographie en phase supercritique
La norme écologique pour l’isolement rapide des composés
La chromatographie en phase supercritique (SFC, Supercritical Fluid Chromatography) fait l’objet de recherches et est sollicitée depuis plusieurs décennies. La technique a considérablement évolué au cours des dix dernières années. On doit cette tendance à la SFC au fait qu’elle a ouvert la voie vers un monde meilleur pour l’ensemble des laboratoires de chimie.

En quoi consiste la SFC ?
Une technique de séparation novatrice
La chromatographie en phase supercritique (SFC, Supercritical Fluid Chromatography) est une technique de séparation similaire à la chromatographie liquide haute pression (HPLC, High-Pressure Liquid Chromatography) mais utilise des fluides supercritiques comme phase mobile. Pour utiliser la SFC, il est donc nécessaire de maintenir la température et la pression au-dessus du niveau critique de la phase mobile dans l’ensemble de la colonne.
La différence de configuration d’un instrument de HPLC et de SFC est présentée ci-après.
Prep HPLC
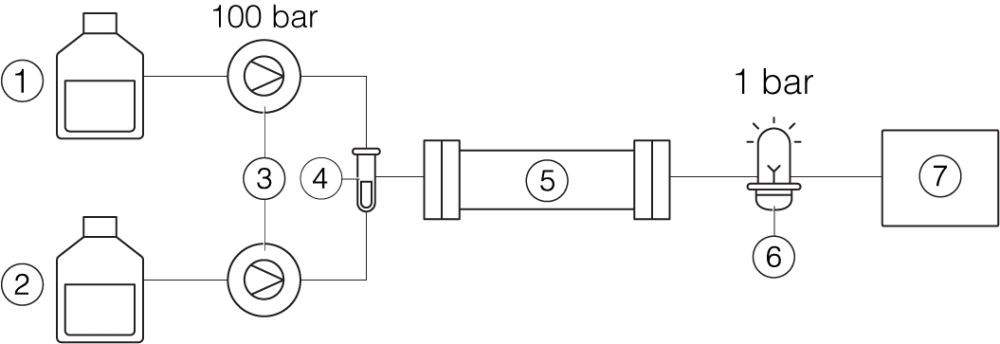
① Solvant A ② Solvant B ③ Pompes ④ Échantillon ⑤ Colonne ⑥ Détecteur UV ⑦ Collecteur de fractions
Prep SFC
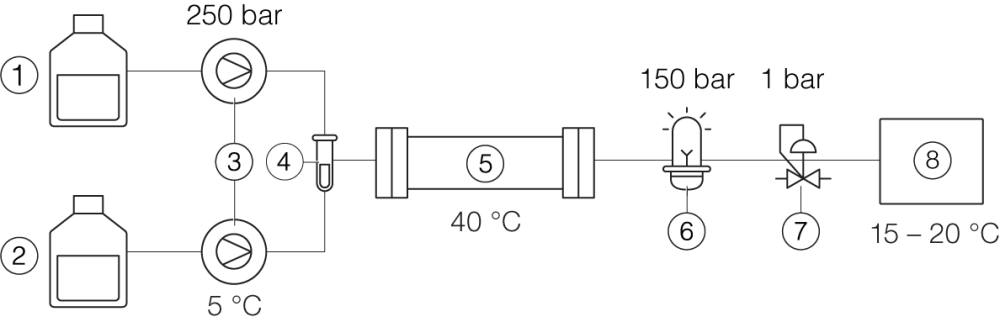
① Solvant A ② CO2 liquide ③ Pompes, y compris le refroidisseur ④ Échantillon ⑤ Colonne, four à colonne ⑥ Détecteur UV ⑦ Régulateur de contre-pression ⑧ Collecteur de fractions
Le rôle du CO2
Le dioxyde de carbone est le fluide supercritique le plus fréquemment utilisé pour plusieurs raisons. Il a une température et une pression critique basse (31 °C et 73,8 bars), est hautement inerte dans la plupart des conditions et non inflammable, sa réactivité est minimale, sa pureté élevée et son coût abordable. Le dioxyde de carbone est également miscible à plusieurs solvants organiques très polaires, contrairement au n-hexane, dont la polarité est faible comparé au dioxyde de carbone supercritique. Ces facteurs permettent à la SFC d’obtenir un large éventail de schémas de séparation.
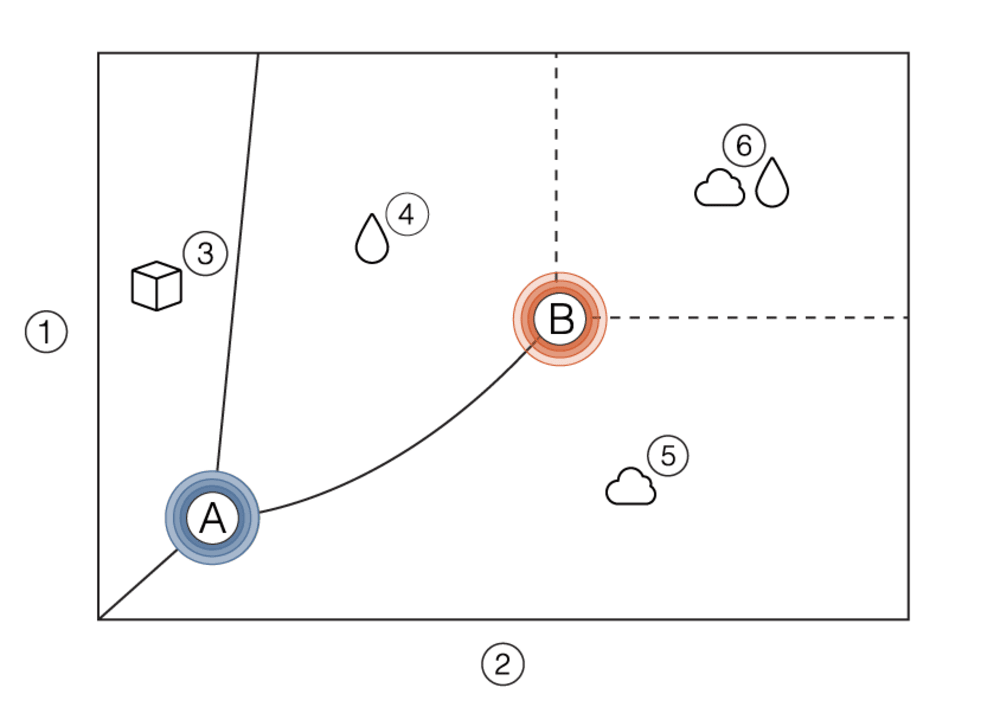
Qu’est-ce qu’un fluide supercritique ?
En fonction des conditions de température et de pression, les substances peuvent être à l’état solide, liquide ou gazeux. Si un liquide ou un gaz est utilisé au-dessus de sa température et de sa pression critiques, il se transforme en fluide supercritique. Les caractéristiques des fluides supercritiques sont intermédiaires entre celles des gaz et des liquides. Un fluide supercritique peut être considéré comme un gaz dense.